수소화 알루미늄 리튬
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소화 알루미늄 리튬(LiAlH₄, LAH)은 무색 고체로, 유기 화학에서 강력한 환원제로 널리 사용된다. 물과 격렬하게 반응하며, 다양한 에테르계 용매에 용해된다. LAH는 에스터, 카복실산, 알데히드, 케톤 등을 알코올로 환원하는 데 사용되며, 아미드, 니트로 화합물, 니트릴 등을 아민으로 변환하는 데에도 활용된다. 또한, 금속 할로겐화물로부터 금속 수소화물을 제조하는 데 사용되며, 수소 저장 매체로도 연구되고 있다. LAH는 실온에서 준안정하며, 장기간 보관하거나 가열하면 분해된다. 취급 시 물과의 반응에 주의해야 하며, 대한민국에서는 위험물로 지정되어 있다.
더 읽어볼만한 페이지
- 금속 수소화물 - 아르신
아르신(AsH₃)은 마늘 또는 생선 냄새가 나는 무색의 독성 기체로, 반도체 제조에 사용되지만 적혈구 파괴를 유발하는 높은 독성 때문에 취급에 주의해야 하며, 과거 화학 무기로 연구되었고 비소 중독 검출에 쓰이는 마쉬 시험의 핵심 물질이다. - 금속 수소화물 - 수소화 우라늄
수소화 우라늄은 우라늄과 수소의 화합물로서, 특정 온도와 압력 조건에서 형성되며 다양한 화학적 특성을 나타낸다. - 알루미늄 화합물 - Alq3
트리스(8-히드록시퀴놀리네이트)알루미늄(Alq₃)은 자오면 및 안면 이성질체와 여러 다형체를 가지며, 유기 발광 다이오드(OLED)의 전자 수송층 물질로 널리 쓰이고 퀴놀린 고리의 치환기 변화를 통해 발광 특성 조절이 가능하다. - 알루미늄 화합물 - 녹주석
녹주석은 육방정계에 속하는 규산염 광물로, 다양한 색상을 띠며 베릴륨 화합물로 알려져 채굴, 취급, 정제 시 폐렴을 유발할 수 있다. - 리튬 화합물 - 유기리튬 시약
유기리튬 시약은 탄소-리튬 결합을 가진 화합물로 카를 치글러, 게오르크 비티히, 헨리 길먼 등에 의해 개발되었으며 극성을 띠는 결합과 강염기성 및 친핵성을 이용하여 유기 합성 반응에서 친핵체, 탈양성자화제, 중합 개시제 등으로 널리 쓰인다. - 리튬 화합물 - 과산화 리튬
과산화 리튬(Li2O2)은 이산화 탄소를 흡수하고 산소를 방출하는 특징으로 밀폐된 공간의 공기 정화나 리튬-공기 전지의 핵심 구성 요소로 사용되는 무기 화합물이다.
| 수소화 알루미늄 리튬 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
| 명칭 | 리튬 테트라히드리도알루미네이트(III) |
| 관용명 | 수소화 알루미늄 리튬 리탈 리튬 알라네이트 리튬 알루미노하이드리드 리튬 테트라히드리도알루미네이트 |
| 약칭 | LAH |
| IUPAC 명칭 | 리튬 알루마누이드 |
| 식별 정보 | |
| CAS 등록번호 | 16853-85-3 |
| UNII | 77UJC875H4 |
| PubChem | 28112 |
| ChemSpider | 26150 |
| EINECS | 240-877-9 |
| ChEBI | 30142 |
| RTECS | BD0100000 |
| SMILES | [Li+].[AlH4-] |
| 표준 InChI | 1S/Al.Li.4H/q-1;+1;;;; |
| 표준 InChIKey | OCZDCIYGECBNKL-UHFFFAOYSA-N |
| Gmelin | 13167 |
| UN 번호 | 1410 |
| 특성 | |
| 화학식 | LiAlH₄ |
| 몰 질량 | 37.95 g/mol |
| 외형 | 흰색 결정 (순수 시료), 회색 분말 (상업용 재료), 흡습성 |
| 냄새 | 무취 |
| 밀도 | 0.917 g/cm³, 고체 |
| 용해도 | 반응함 |
| 테트라히드로푸란 용해도 | 112.332 g/L |
| 다이에틸 에테르 용해도 | 39.5 g/100 mL |
| 녹는점 | 150 °C (분해) |
| 구조 | |
| 결정 구조 | 단사정계 |
| 공간군 | P2₁/c |
| 열화학 | |
| 표준 생성 엔탈피 | -117 kJ/mol |
| 표준 깁스 자유 에너지 | -48.4 kJ/mol |
| 엔트로피 | 87.9 J/(mol·K) |
| 열용량 | 86.4 J/(mol·K) |
| 위험성 | |
| 신호어 | 위험 |
| 인화점 | 125 °C |
| NFPA 704 | H: 3 R: 2 F: 2 S: W |
| 관련 화합물 | |
| 관련 기능 | 수소화물 |
| 관련 화합물 | 수소화 알루미늄 수소화 붕소 나트륨 수소화 나트륨 수소화 알루미늄 나트륨 |
2. 성질, 구조, 제법
수소화 알루미늄 리튬(LAH)은 무색 고체이지만, 불순물 때문에 상업용 제품은 회색을 띠는 경우가 많다.[5] 다이에틸 에테르로 재결정화하여 정제할 수 있으며, 대규모 정제에는 속슬렛 추출기를 사용한다. 불순물이 무해하고 쉽게 분리되기 때문에, 불순한 회색 물질을 합성에 사용하기도 한다. 순수한 분말 형태의 LAH는 자연 발화성을 띠지만, 큰 결정은 그렇지 않다.[6] 일부 상업용 제품에는 광유가 포함되어 수분과의 반응을 억제하기도 하지만, 방습 플라스틱 자루에 포장하는 것이 일반적이다.[7]
LAH는 물, 특히 대기 중 수분과 격렬하게 반응하여 수소 기체를 발생시킨다.[5] 이 반응은 실험실에서 수소를 만드는 데 유용하게 사용된다. 오래되어 공기에 노출된 LAH 샘플은 흡수한 수분 때문에 수산화 리튬과 수산화 알루미늄 혼합물이 생성되어 흰색으로 보이기도 한다.[8]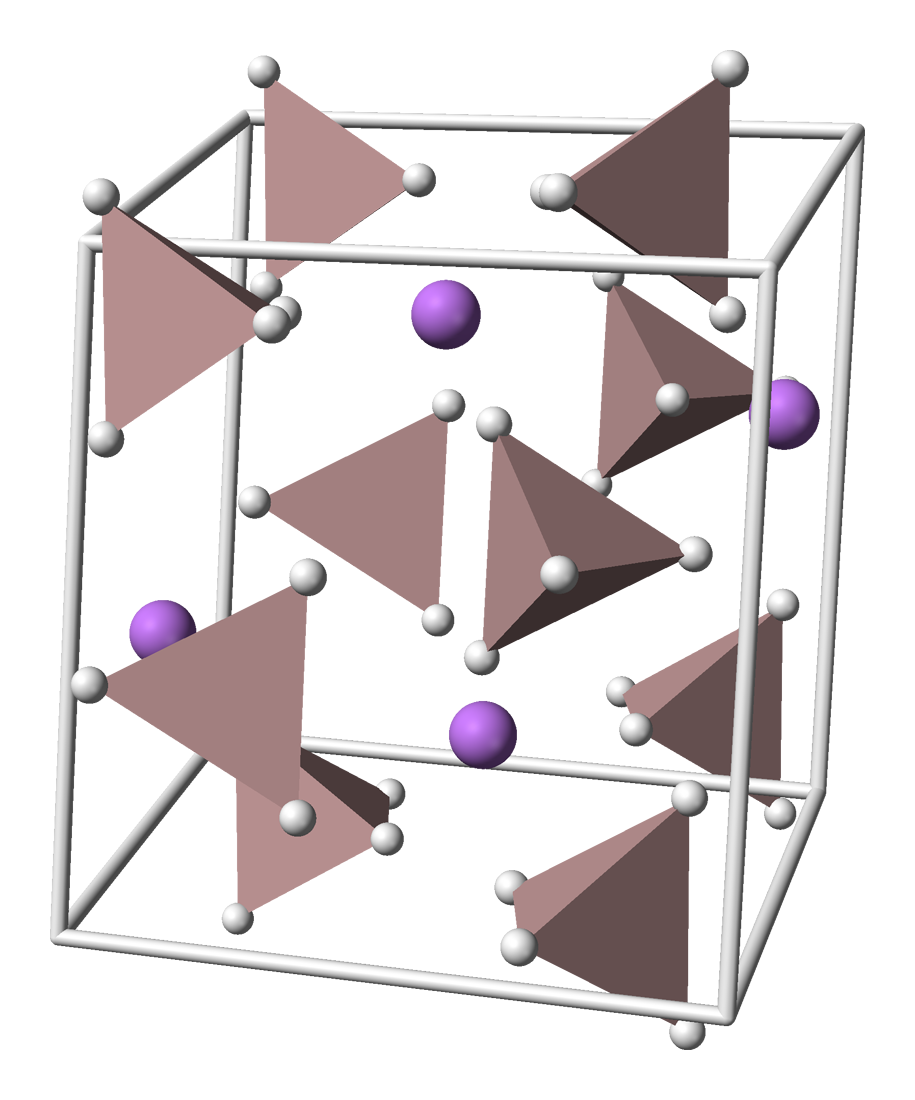
LAH는 단사정계 공간군 ''P''21/''c''로 결정화된다. 단위 세포의 크기는 ''a'' = 4.82 Å, ''b'' = 7.81 Å, ''c'' = 7.92 Å, α = γ = 90°, β = 112°이다. 구조는 양이온이 5개의 사면체 분자 기하 구조 음이온에 둘러싸여 있으며, 양이온은 주변의 사면체 음이온 각각에서 하나의 수소 원자와 결합하여 이중 피라미드 배치를 이룬다. 2.2 GPa 이상의 고압에서는 상 전이가 일어나 β-LAH가 생성될 수 있다.[9]
LAH는 수소화 리튬(LiH)과 염화 알루미늄의 반응을 통해 처음 제조되었다.[4][5]
:
산업적으로는 고온 고압에서 원소로부터 수소화 알루미늄 나트륨을 먼저 제조한 후, 염 치환 반응을 통해 LAH를 제조한다.[10]
:
:
이 반응은 높은 수율로 진행되며, 염화 리튬은 LAH의 디에틸 에테르 용액에서 여과하여 제거하고 LAH를 침전시켜 약 1% w/w LiCl을 함유하는 생성물을 얻는다.[10] LiH와 금속 Al을 사용하고 소량의 (0.2%)를 촉매로 사용하는 방법도 있으며, 디메틸 에테르를 용매로 사용하면 염의 동시 생성을 피할 수 있다.[11]
LAH는 실온에서 준안정하며, 장기간 보관 시 lithium aluminium hexahydride영어()와 LiH로 서서히 분해된다.[13] 이 과정은 티타늄, 철, 바나듐과 같은 촉매 원소의 존재에 의해 가속될 수 있다.
가열하면 LAH는 다음 3단계의 반응 메커니즘으로 분해된다:[13][14][15]
#
#
#
반응 R1은 일반적으로 150~170 °C 온도 범위에서 LAH가 용융되며 시작되고,[16][17][18] 즉시 고체 로 분해되지만, 융점 아래에서도 진행되는 것으로 알려져 있다.[19] 약 200 °C에서 은 LiH와 Al로 분해되며(R2),[13][15][18] 이는 400 °C 이상에서 LiAl로 변환된다(R3).[15] 반응 R1은 사실상 비가역적이다. R3은 500 °C에서 약 0.25 bar의 평형 압력으로 가역적이다. R1 및 R2는 적절한 촉매를 사용하면 실온에서도 발생할 수 있다.[20]
2. 1. 용해도
LAH영어는 다양한 에테르계 용매에 용해된다. 촉매가 될 수 있는 불순물이 존재할 때는 자발적으로 분해되지만, 테트라하이드로푸란(THF)에서는 안정성이 더 높다. 따라서 다이에틸 에테르보다 용해도가 낮음에도 불구하고 THF를 더 많이 사용한다.[12]| 용매 | 온도 (°C) | ||||
|---|---|---|---|---|---|
| 0 | 25 | 50 | 75 | 100 | |
| 다이에틸 에테르 | – | 5.92 | – | – | – |
| 테트라하이드로푸란 | – | 2.96 | – | – | – |
| 모노글라임 | 1.29 | 1.80 | 2.57 | 3.09 | 3.34 |
| 다이글라임 | 0.26 | 1.29 | 1.54 | 2.06 | 2.06 |
| 트리그라임 | 0.56 | 0.77 | 1.29 | 1.80 | 2.06 |
| 테트라글라임 | 0.77 | 1.54 | 2.06 | 2.06 | 1.54 |
| 다이옥산 | – | 0.03 | – | – | – |
| 다이부틸 에테르 | – | 0.56 | – | – | – |
주의: LiAlH4영어를 사용하는 반응에는 물을 용매로 사용하면 안 된다. 물과 LAH영어는 격렬하게 반응한다.
2. 2. 열역학적 데이터
표준 상태의 엔탈피, 엔트로피, 깁스 자유 에너지 변화를 포함하여 수소화 알루미늄 리튬(lithium aluminium hydride|리튬 알루미늄 하이드라이드영어)과 관련된 반응에 대한 열역학 데이터를 아래 표에 요약하였다.| 반응 | ΔH° (kJ/mol) | ΔS° (J/(mol·K)) | ΔG° (kJ/mol) | 비고 |
|---|---|---|---|---|
| (s) | −116.3 | −240.1 | −44.7 | 원소로부터의 표준 생성. |
| LiH (s) + Al (s) + H2 (g) → LiAlH4 (s) | −95.6 | −180.2 | 237.6 | ΔH°f(LiH) = −90.579865, ΔS°f(LiH) = −679.9, and ΔG°f(LiH) = −67.31235744을 사용. |
| (l) | 22 | – | – | 융해열. 값은 신뢰할 수 없을 수 있음. |
| LiAlH4 (l) → Li3AlH6 (s) + Al (s) + H2 (g) | 3.46 | 104.5 | −27.68 | ΔS°는 보고된 ΔH° 및 ΔG° 값에서 계산됨. |
2. 3. 열분해
LAH영어는 실온에서 준안정하며, 장기간 보관하면 lithium aluminium hexahydride영어()와 LiH로 서서히 분해된다.[13] 이 과정은 티타늄, 철 또는 바나듐과 같은 촉매 원소의 존재에 의해 가속될 수 있다.
가열하면 LAH영어는 다음 3단계의 반응 메커니즘으로 분해된다:[13][14][15]
#
#
#
반응 R1은 일반적으로 150~170 °C 온도 범위에서 LAH영어가 용융되며 시작되고,[16][17][18] 즉시 고체 로 분해되지만, 융점 아래에서도 진행되는 것으로 알려져 있다.[19] 약 200 °C에서 은 LiH와 Al로 분해되며(R2),[13][15][18] 이는 400 °C 이상에서 LiAl로 변환된다(R3).[15] 반응 R1은 사실상 비가역적이다. R3은 500 °C에서 약 0.25 bar의 평형 압력으로 가역적이다. R1 및 R2는 적절한 촉매를 사용하면 실온에서도 발생할 수 있다.[20]
3. 유기화학에서의 활용
수소화 알루미늄 리튬(LAH)은 유기 화학에서 강력한 환원제로 널리 사용된다.[5] 붕수소화 나트륨보다 더 강력한데, 이는 Al-H 결합이 B-H 결합보다 약하기 때문이다.[23]
LAH는 주로 에스터[28][29]와 카복실산[30]을 1차 알코올로 환원하는 데 사용된다. LAH가 등장하기 전에는 끓는 에탄올에서 나트륨 금속을 사용하는 부보-블랑 환원을 통해 이 변환을 수행했다. 알데히드와 케톤[31]도 LAH에 의해 알코올로 환원될 수 있지만, 일반적으로는 붕수소화 나트륨과 같은 더 순한 시약을 사용한다. α, β-불포화 케톤은 알릴 알코올로 환원된다.[32] 아미드,[24][25] 니트로 화합물, 니트릴, 이민, 옥심[26] 및 유기 아자이드는 LAH에 의해 아민으로 환원된다.
에폭사이드를 LAH로 환원하면, 시약이 에폭사이드의 입체 장애가 적은 쪽을 공격하여 일반적으로 2차 또는 3차 알코올을 생성한다.[33] 에폭시사이클로헥산은 축 알코올을 우선적으로 생성하도록 환원된다.[33]
산 클로라이드를 부분적으로 환원하여 알데히드를 얻는 것은 LAH로는 불가능하다. 대신, 알데히드보다 산 클로라이드와 훨씬 빠르게 반응하는 트리-tert-부톡시알루미늄 수소화 리튬을 사용해야 한다. 예를 들어, 이소발레르산을 염화 티오닐로 처리하여 이소발레로일 클로라이드를 얻은 다음, 트리-''tert''-부톡시알루미늄 수소화 리튬을 통해 65% 수율로 이소발레르알데히드로 환원할 수 있다.[34][35]
알킬 할라이드는 LAH에 의해 알칸으로 환원될 수 있다.[36][37] 알킬 아이오다이드가 가장 빠르게 반응하고, 그 다음 알킬 브로마이드, 알킬 클로라이드 순이다. 1차 할로겐화물이 가장 반응성이 높고, 그 다음 2차 할로겐화물, 3차 할로겐화물은 특정 경우에만 반응한다.[38]
LAH는 단순한 알켄이나 아렌은 환원시키지 않는다. 알킨은 알코올 그룹이 근처에 있는 경우에만 환원되고,[39] 알켄은 촉매 TiCl4가 존재할 때 환원된다.[40]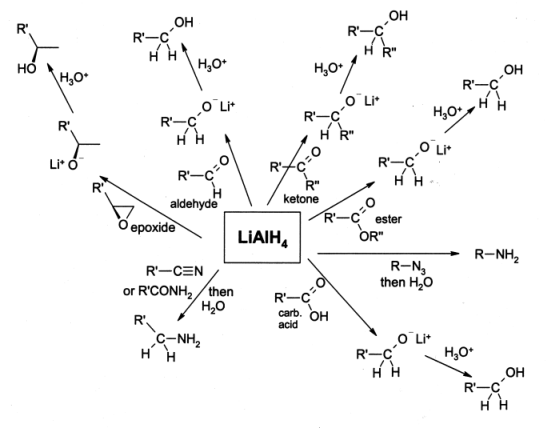
3. 1. 반응 메커니즘
가 분해됨과 동시에 유도 효과 또는 메조메릭 효과에 의해 낮은 전자 밀도를 가진 유기 화합물의 활성 중심을 하이드라이드 이온(H-)이 공격한다.[41]4. 무기화학에서의 활용
LAH는 해당 금속 할로겐화물로부터 주족 및 전이 금속 수소화물을 제조하는 데 널리 사용된다.[21]
LAH는 또한 많은 무기 리간드와 반응하여 리튬 이온과 관련된 배위된 알루미나 복합체를 형성한다.[21]
:LiAlH4 + 4NH3 → Li[Al(NH2)4] + 4H2
5. 수소 저장
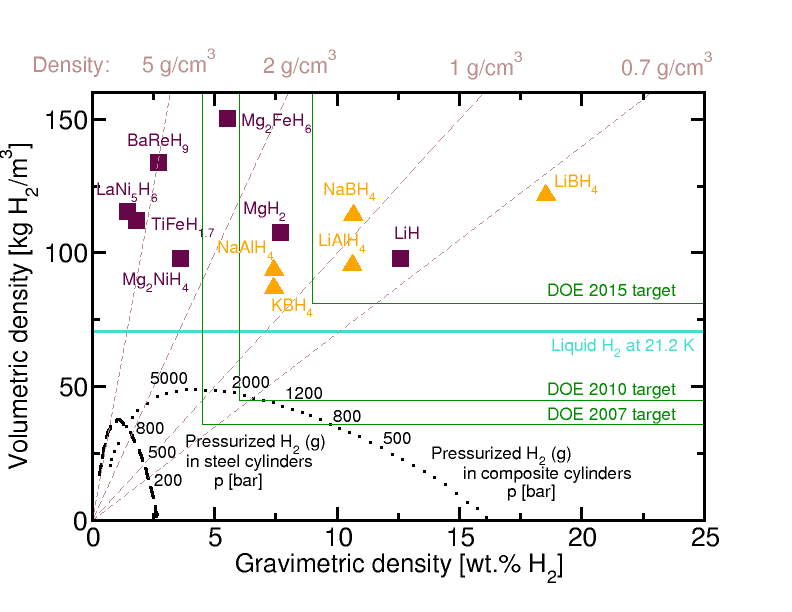
수소화 알루미늄 리튬(LiAlH4, LAH)은 10.6 wt%의 수소를 함유하고 있어 미래의 연료 전지 구동 자동차의 잠재적인 수소 저장 매체로 주목받고 있다. 높은 수소 함량과 더불어, 타이타늄(Ti)을 도핑한 NaAlH4에서 가역적인 수소 저장이 발견되면서[42] 지난 10년 동안 LiAlH4에 대한 연구가 활발하게 진행되었다. 특히 촉매 도핑 및 볼 밀링을 통해 분해 속도를 가속화하기 위한 연구가 많이 이루어졌다.[43]
LiAlH4의 전체 수소 용량을 활용하기 위해서는 중간 화합물인 LiH도 탈수소화해야 한다. 그러나 LiH는 열역학적으로 매우 안정하여 이 과정에 400 °C 이상의 고온이 필요하며, 이는 운송 목적에는 적합하지 않다. LiH + Al을 최종 생성물로 사용할 경우 수소 저장 용량은 7.96 wt%로 감소한다.
LiAlH4로의 재활용(재수소화) 문제도 해결해야 할 과제이다. LiAlH4는 안정성이 낮아 재활용을 위해서는 10000 bar 이상의 매우 높은 수소 압력이 필요하다.[43] Li3AlH6를 출발 물질로 사용하여 반응 R2만 순환시킬 경우, 한 번의 단계로 5.6 wt%의 수소를 저장할 수 있다. 이는 NaAlH4가 두 단계를 거쳐 저장하는 수소의 양과 유사하다. 그러나 현재까지 이 과정은 성공하지 못했다.
6. 기타 테트라히드로알루미네이트
수소화 알루미늄 나트륨(NaAlH4)은 NaH과 수소화 알루미늄 리튬(LAH)을 테트라히드로푸란(THF)에서 치환 반응시켜 효율적으로 생성할 수 있다.[44]
:LiAlH4 + NaH → NaAlH4 + LiH
수소화 알루미늄 칼륨(KAlH4)은 디글라임을 용매로 하여 유사하게 생성할 수 있다.[44]
:LiAlH4 + KH → KAlH4 + LiH
LiCl 또는 수소화 리튬을 다이에틸 에테르나 THF에서 반응시켜 수소화 알루미늄 나트륨이나 수소화 알루미늄 칼륨으로부터 LAH를 생성할 수도 있다.[44]
:NaAlH4 + LiCl → LiAlH4 + NaCl
:KAlH4 + LiCl → LiAlH4 + KCl
"알란산 마그네슘"(Mg(AlH4)2)은 MgBr2을 사용하여 유사하게 생성된다.[45]
:2 LiAlH4 + MgBr2 → Mg(AlH4)2 + 2 LiBr
레드-알(NaAlH2(OC2H4OCH3)2)은 수소화 알루미늄 나트륨(NaAlH4)과 2-메톡시에탄올을 반응시켜 합성한다.[46]
7. 위험성
Lithium aluminium hydride|수소화 알루미늄 리튬영어(LAH)은 물 반응성 물질로, 물과 격렬하게 반응하여 수소 기체를 발생시키며 폭발할 수 있다.[5] 따라서 무수 조건에서 취급해야 한다.
순수한 LAH는 자연 발화성을 가지며,[6] 정전기 등에 의해 발화될 수 있다. 발화 시 물이나 이산화 탄소 소화기를 사용하면 안 되고, 분말 소화기를 사용해야 한다. 트리플루오로아세틸기를 가진 화합물을 LAH로 환원하면 폭발성 착물을 형성하여 격렬한 폭발을 일으킬 수 있다.
대한민국에서는 소방법에 따라 제3류 위험물(금속 수소화물)로 지정되어 있다.
8. 반응 후 처리 (퀀칭)
LAH는 반응성이 매우 높아 반응이 끝난 후 처리할 때 신중하게 분해해야 한다.[1] 또한 처리 방법에 따라 알루미늄을 포함한 불용성 침전물이 많이 생길 수 있는데, 여기에 목적물이 흡착되면 수율이 낮아지는 원인이 된다.[1] 이를 막기 위해 여러 방법들이 알려져 있다.[1]
- X g의 LAH로 환원 반응을 한 반응액에, X mL의 물, X mL의 15% 수산화 나트륨 수용액, 3X mL의 물을 차례대로 '''천천히''' 넣고, 잠시 실온에서 섞는다.[1] 회색 침전이 생기면 셀라이트 등을 사용하여 흡인 여과하고, 최소 50X mL 이상의 용매로 씻어낸다.[1] 용매를 증류하여 제거하면 목적물을 얻을 수 있다.[1]
- 망초 (황산 나트륨 십수화물)를 대량으로 넣어, 포함된 수분에 의해 LAH를 분해한다.[1] 아세트산 에틸을 넣어 묽어질 때까지 섞고, 불용물을 셀라이트 등을 사용하여 여과한 후, 용매를 증류하여 제거한다.[1]
- 로셸 염 (타타르산 칼륨 나트륨) 포화 수용액을 저온에서 천천히 넣고, 30분 정도 섞으면 알루미늄 염이 타타르산과 킬레이트 착물을 형성하여 용해된다.[1] 이를 분액 처리한다.[1]
- 0 °C로 냉각한 후 포화 염화 암모늄 수용액을 넣어 반응을 멈추게 한다.[1] 이 회색 에멀젼에 트리에틸아민/메탄올/아세트산 에틸 3:10:87 혼합액 (반응 용매의 THF에 대해 2.5배량)을 넣고, 셀라이트 등을 사용하여 여과한다.[1] 여액을 통상적으로 분액 처리하여 목적물을 얻는다.[1]
LAH를 처리하는 다른 방법들은 다음과 같다.[1]
참조
[1]
간행물
[2]
웹사이트
2018-06-01
[3]
웹사이트
Lithium aluminium hydride
https://cameochemica[...]
[4]
논문
Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry
[5]
백과사전
Lithium Aluminium Hydride
https://books.google[...]
New Africa Books
[6]
서적
Practical Organic Synthesis: A Student's Guide
https://archive.org/[...]
John Wiley and Sons
[7]
논문
Dehydrogenation Kinetics of as-Received and Ball-Milled LiAlH4
http://dcwww.camd.dt[...]
2010-05-07
[8]
서적
Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens
William Andrew Publishing
[9]
논문
Crystal Structure and Thermodynamic Stability of the Lithium Alanates LiAlH4 and Li3AlH6
[10]
서적
Lehrbuch der Anorganischen Chemie
https://books.google[...]
de Gruyter
[11]
논문
Ti-Doped LiAlH4 for Hydrogen Storage: Synthesis, Catalyst Loading and Cycling Performance
[12]
논문
Solubility of Lithium Aluminum Hydride and Lithium Borohydride in Diethyl Ether
[13]
논문
[14]
논문
Thermal Decomposition of Complex Metal Hydrides
[15]
논문
Desorption of LiAlH4 with Ti- and V-Based Additives
[16]
논문
Reversible Hydrogen Storage via Titanium-Catalyzed LiAlH4 and Li3AlH6
[17]
논문
Solid State Phase Transformations in LiAlH4 during High-Energy Ball-Milling
https://zenodo.org/r[...]
[18]
논문
Effect of Ti-Doping on the Dehydrogenation Kinetic Parameters of Lithium Aluminum Hydride
[19]
논문
Dehydrogenation Kinetics of as-Received and Ball-Milled LiAlH4
[20]
논문
Titanium Catalyzed Solid-State Transformations in LiAlH4 During High-Energy Ball-Milling
https://zenodo.org/r[...]
[21]
서적
Handbook of Inorganic Chemicals
https://archive.org/[...]
McGraw-Hill
[22]
논문
Heats and Free Energies of Formation of the Alkali Aluminum Hydrides and of Cesium Hydride
[23]
논문
Reductions by Lithium Aluminum Hydride
[24]
간행물
Chiral Media for Asymmetric Solvent Inductions. (S,S)-(+)-1,4-bis(Dimethylamino)-2,3-Dimethoxybutane from (R,R)-(+)-Diethyl Tartrate
[25]
간행물
Macrocyclic Diimines: 1,10-Diazacyclooctadecane
[26]
간행물
(2S)-(−)-3-exo-(Morpholino)Isoborneol
[27]
웹사이트
Red-Al, Sodium bis(2-methoxyethoxy)aluminumhydride
https://www.organic-[...]
Organic Chemistry Portal
[28]
간행물
Preparation of Enantiomerically Pure α-N,N-Dibenzylamino Aldehydes: S-2-(N,N-Dibenzylamino)-3-Phenylpropanal
[29]
간행물
3-
[30]
간행물
(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane
[31]
간행물
Cyclopropanecarboxaldehyde
[32]
간행물
Reductive Cleavage of Allylic Alcohols, Ethers, or Acetates to Olefins: 3-Methylcyclohexene
[33]
논문
Stereochemistry and Mechanism of Lithium Aluminum Hydride and Mixed Hydride Reduction of 4-''t''-Butylcyclohexene Oxide
[34]
서적
Organic Chemistry
Pearson Prentice Hall
[35]
서적
Organic chemistry
Pearson
2013
[36]
논문
Hydrogenolysis of Alkyl Halides by Lithium Aluminum Hydride
[37]
논문
Selective Reductions. 28. The Fast Reaction of Lithium Aluminum Hydride with Alkyl Halides in THF. A Reappraisal of the Scope of the Reaction
[38]
서적
Some Modern Methods of Organic Synthesis
https://books.google[...]
Cambridge University Press
[39]
간행물
2-Alkenyl Carbinols from 2-Halo Ketones: 2-E-Propenylcyclohexanol
[40]
뉴스
"Hydride reducing agents" (letter to the editor) in ''Chemical and Engineering News''
1981-05-11
[41]
논문
Reduction of N-allylamides by LiAlH4: Unexpected Attack of the Double Bond With Mechanistic Studies of Product and Byproduct Formation
[42]
논문
Ti-Doped Alkali Metal Aluminium Hydrides as Potential Novel Reversible Hydrogen Storage Materials
[43]
서적
Nanomaterials for Solid State Hydrogen Storage
Springer
[44]
논문
Synthesis of Alkali Metal Hexahydroaluminate Complexes Using Dimethyl Ether as a Reaction Medium
[45]
서적
Inorganic Chemistry
https://books.google[...]
Academic Press
[46]
논문
The chemistry of sodium alkoxyaluminium hydrides. I. Synthesis of sodium bis(2-methoxyethoxy)aluminium hydride
[47]
서적
ボルハルト・ショア―現代有機化学(上)
化学同人
[48]
논문
水素化アルミニウムリチウム
https://doi.org/10.5[...]
2013
[49]
문서
CLP Regulation
[50]
웹사이트
2018-06-01
[51]
웹사이트
Lithium aluminium hydride
https://cameochemica[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
